ここから本文です。
厚生労働省・認定臨床研究審査委員会への報告
本ページ上の認定臨床研究審査委員会は、奈良県立医科大学臨床研究審査会と読み替えてください。
- 研究実施中
>疾病・不具合等報告
>定期報告
>重大な不適合報告 - 研究終了時
● 研究実施中
>疾病・不具合等報告について
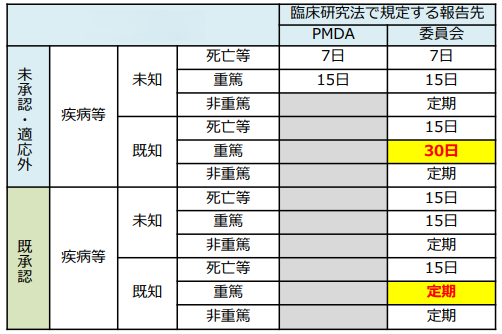
特定臨床研究の実施中に、下記の表に示す疾病・不具合が発生した際には、実施医療機関の管理者及び認定臨床研究審査委員会に報告することが、統括管理者に義務付けられています。報告の対象となるのは、特定臨床研究の実施に起因すると疑われる疾病・不具合です。(医学系指針における有害事象とは異なる定義です。)
その内、未承認・適応外の医薬品等を用いる特定臨床研究であって、予測できない死亡及び重篤な疾病等については、報告期間内(下記表参照)に厚生労働大臣へ報告することが義務付けられています。
▶ 厚生労働大臣(医薬品医療機器総合機構:PMDA)への報告は、jRCTの入力フォームより報告書(別紙様式 第2-1又は第2-2)を作成してください。それによりPDF・XMLファイルが作成されますので、両ファイルを医薬品医療機器総合機構(trkshippeitouhokoku@pmda.go.jp)に送信してください。
▶ 認定臨床研究審査委員会への報告に必要な書類はこちらから
-疾病等報告の報告対象と報告期限等-
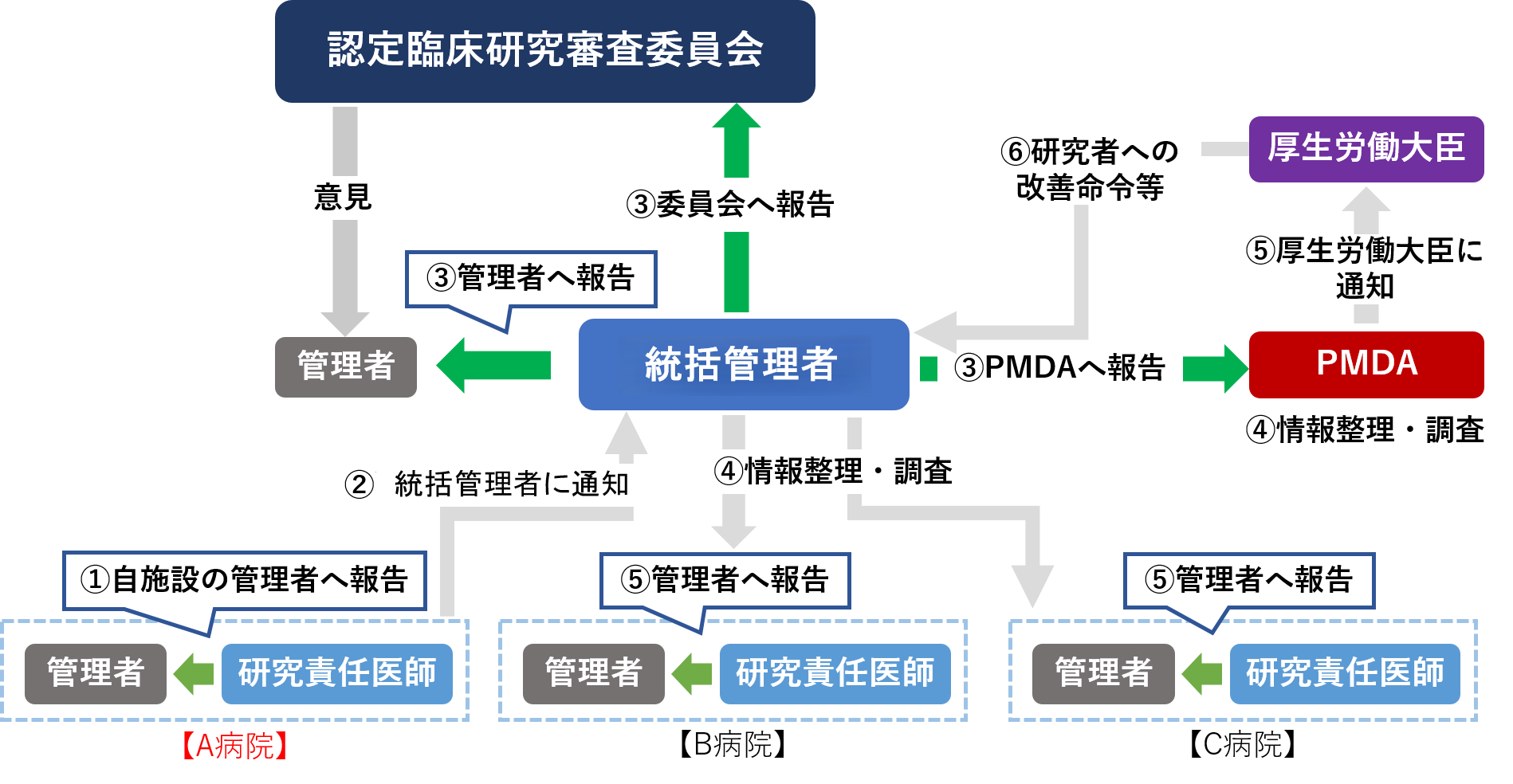
-多施設共同研究における疾病等報告のフロー(施行規則第54~56条)-
例:A病院で、特定臨床研究による疾病等が発生した場合
特定臨床研究の実施に起因すると疑われる疾病等のうち、上記の表に該当しない疾病等については、認定臨床研究審査委員会への定期報告時に報告することが定められています。
>定期報告
統括管理者は、臨床研究の実施状況・疾病等の発生状況について、実施計画を厚生労働大臣に提出した日(実施計画の初回公表日)から1年毎に報告しなければならないと定められています。
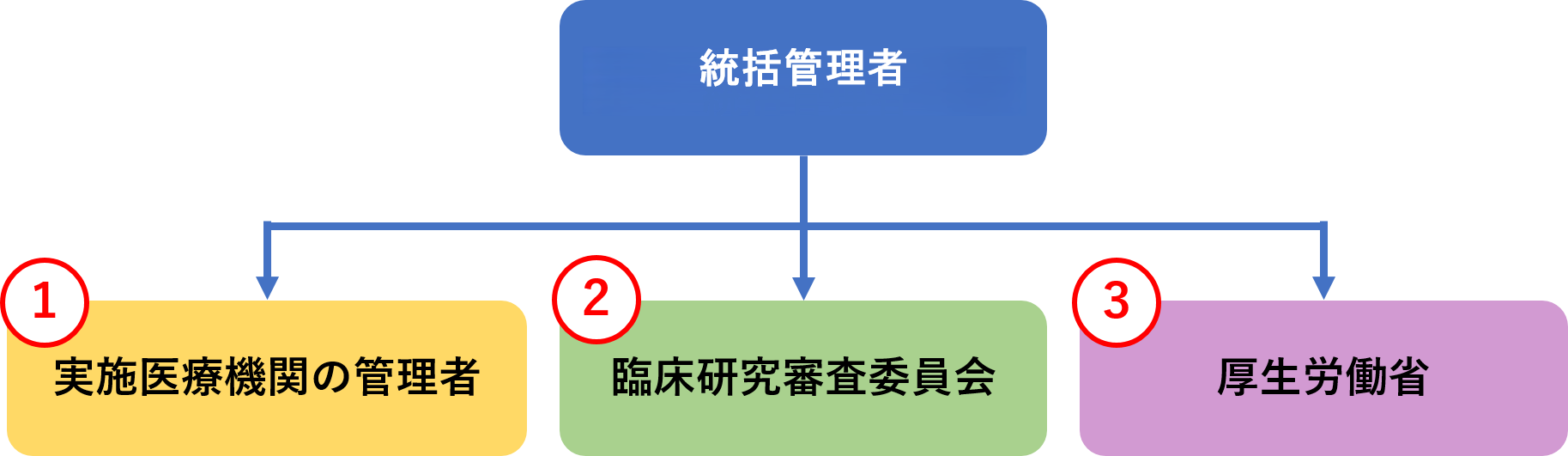
1.実施医療機関の管理者に報告したうえで、2.認定臨床研究審査委員会へ報告し、認定臨床研究審査委員会が意見を述べた日から起算して1ヵ月以内に3.厚生労働大臣への報告を行うことが義務付けられています。
1.実施医療機関の管理者への定期報告
2.認定臨床研究審査委員会への定期報告事項
<報告事項>
- 臨床研究に参加した対象者の数
- 臨床研究に係る疾病等の発生状況及びその他の経過
- 省令又は研究計画書に対する不適合の発生状況及びその他の対応
- 安全性及び科学的妥当性についての評価
- 管理が必要な利益相反の関与に関する事項
<報告期限>
- 実施計画を厚生労働大臣に提出した日から起算して1年毎に、当該機関満了後2ヵ月以内に認定臨床研究審査委員会に報告
<報告様式>
- 認定臨床研究審査委員会への報告様式はこちらから
3.厚生労働大臣への定期報告
<報告事項>
- 実施計画に記載されている認定臨床研究審査委員会の名称
- 当該委員会による研究継続の適否
- 臨床研究に参加した対象者の数
<報告期限>
- 認定臨床研究審査委員会が意見を述べた日から起算して1ヵ月以内に厚生労働大臣に報告
<報告様式>
- 厚生労働大臣への報告様式はこちら【別紙様式3】 jRCTに入力し作成してください。
>重大な不適合報告
統括管理者は、臨床研究が臨床研究法施行規則(平成三十年厚生労働省令第十七号)又は研究計画書に適合していない状態(以下「不適合」という。)であると知ったときは、速やかに、実施医療機関の管理者に報告することが義務付けられています。また、不適合のうち、特に重大なものが判明した場合においては、速やかに認定臨床研究審査委員会の意見を聴かなければならないとされています。
「重大な不適合」とは、臨床研究の対象者の人権や安全性及び研究の進捗や結果の信頼性に影響を及ぼすものをいいます。例えば、選択・除外基準や中止基準、併用禁止療法等の不遵守をいい、臨床研究の対象者の緊急の危険を回避するためその他医療上やむを得ない理由により研究計画書に従わなかったものについては含みません。
▶ 認定臨床研究審査委員会への報告様式はこちら
● 研究終了時
統括管理者は、
・主要評価項目データの収集期間が終了した日から1年以内に主要評価項目報告書
・全てのデータの収集期間が終了した日から1年以内に総括報告書・総括報告書の概要
をそれぞれ作成し、認定臨床研究審査委員会の意見を聴いたうえで厚生労働大臣に報告することが定められています。
主要評価項目報告書および総括報告書を作成しなければならない時期が同時期の場合は、総括報告書の作成により主要評価項目報告書の作成をしたものとみなすことができます。
▶ 認定臨床研究審査委員会への報告様式はこちら
Copyright © 奈良県立医科大学臨床研究審査会. All Rights Reserved.
