ホーム > 研究・産学官連携 > 先端医学研究支援機構 > 研究内容
ここから本文です。
更新日:2025年9月3日
研究内容
研究内容
1)プロトカドヘリンがつくるニューロンの個性
複雑な脳機能を支えるためには、個々のニューロンが「自己」と「非自己」を見分けるしくみが必要です。当研究室では、このしくみに重要な役割を果たす分子群「クラスター型プロトカドヘリン(cPcdh)」に注目しています。マウス脳をモデルとして、cPcdhによる“細胞の個性”がどこに生じるのか、またこの“Pcdhコード”が脳の発達にどう関わるのか、さらにこの“Pcdhコード”の破綻が脳の疾患にどのように関与するのかを明らかにしつつあります。
Neuronal Identity Shaped by Protocadherins
To support complex brain functions, individual neurons must distinguish between "self" and "non-self." Our laboratory focuses on a family of molecules called clustered protocadherins (cPcdhs), which play a critical role in this process. Using the mouse brain as a model, we are investigating where cPcdh-mediated cellular identity arises, how this “cPcdh code” contributes to brain development, and how its disruption may be involved in brain disorders.
2)モノクローナル抗体を用いた研究
2-1)DNA修復研究のための強力なツール;DNA損傷特異モノクローナル抗体
DNA修復研究を行うにはDNA損傷の測定が必須ですが、高感度・高精度でしかも簡易に測定できる既製の方法などまず存在しません。そこで、私達はNERの基質となるDNA損傷はDNA構造を大きく歪ませるので抗原性を持つだろうと考え、損傷を誘発した1本鎖DNAとメチル化牛血清アルブミンの結合体などでマウスに免疫後、KohlerとMilsteinのハイブリドーマ作製法に基づきDNA損傷特異モノクローナル抗体の作製を試みました。その結果、これまでに紫外線誘発の3種類のピリミジン二量体型DNA損傷特異抗体、アセチルアミノフルオレン-DNA付加体特異抗体、エクインエストロゲン-DNA付加体特異抗体、および酸化的DNA損傷サイクロプリン特異抗体の合計6種類の作製に成功しました。1例(世界2番目)を除き5種類は世界初の抗体であり、その内4種類は世界オンリーワン抗体です。全ての抗体は対応するDNA損傷に対し特異性および親和性に優れており、酵素標識免疫法(ELISA法)に応用して高感度にDNA損傷を測定できるだけでなく、免疫染色法に応用して細胞内のDNA損傷を観察することもできます。それ故、DNA損傷特異モノクローナル抗体は今やDNA修復研究に欠かせない強力な実験ツールになっており、私達を独創的な研究分野に導いてくれています。
2-2)紫外線誘発DNA損傷に対するモノクローナル抗体
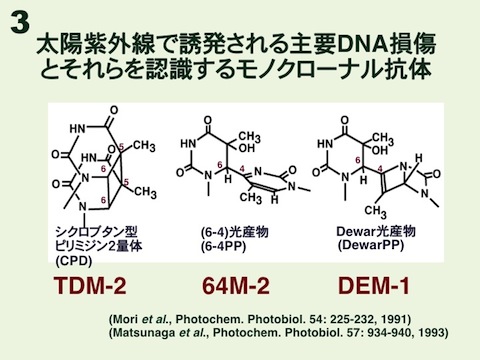
地表に到達する太陽紫外線は295-400nmの波長域からなります。短波長側の紫外線(UVB域,295-320nm)は細胞内DNAに直接吸収され、chromophoreである塩基中の共役2重結合を励起します。その結果、同じDNA鎖中の連続した二つのピリミジン塩基間で共有結合が生じ、シクロブタン型ピリミジン二量体(CPD)および(6-4)型光産物(6-4PP)を形成します。同時に、長波長側の紫外線(UVA域,320-400nm)は6-4PPをDewar型光産物(DewarPP)に光異性化(構造変換)します(図3)。この3種類の主要DNA損傷は紫外線発がんの原因と考えられており、それらの修復能を欠損する色素性乾皮症(XP)患者が太陽露光部に高頻度に皮膚がんを発症することは有名です。太陽光による損傷形成量はCPDが最大であり、全体の約8割を占めます。
私達はUV-ssDNA-mBSA(紫外線照射1本鎖DNAとメチル化BSAの結合体)を抗原に用い、DNA中のCPD、6-4PP、およびDewarPPに対する抗体として、それぞれTDM-2、64M-2、およびDEM-1を作製しました。CPD抗体は世界で2番目、6-4PPおよびDewarPP抗体は世界初のものです。いずれの抗体も損傷特異性および親和性に優れ、4種類全てのピリミジン-ピリミジン配列(TT,TC,CT,CC)に形成する損傷に結合します。TDM-2抗体の最大結合に必要な抗原の構造は、中央にcis-syn型CPDを含む1本鎖テトラヌクレオチド(pNPy<>PyN)です。つまり、TDM-2はシクロブタン型リングをまず認識し、二量体の5’側および3’側のヌクレオシド、および二量体の5’側あるいは3’側のリン酸グループの存在で結合が安定します。64M-2抗体の場合も6-4PPがエピトープであり、その5’側および3’側のヌクレオチドの存在で結合が安定します。
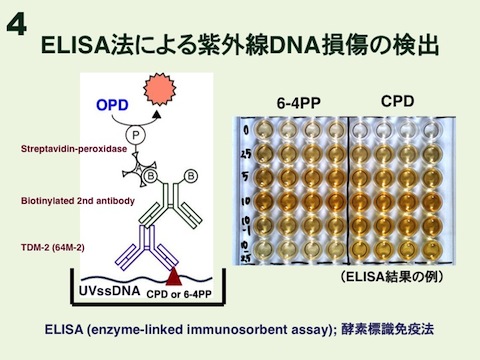
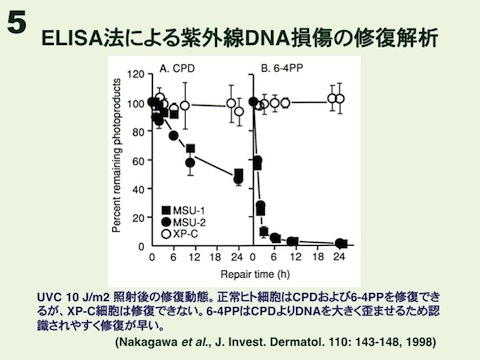
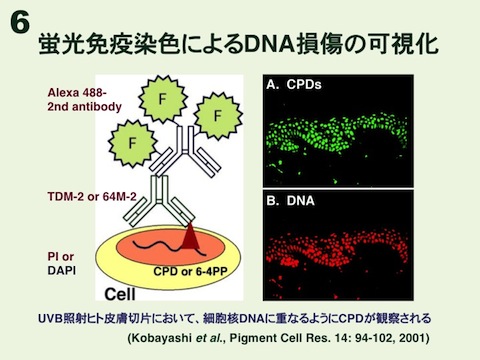
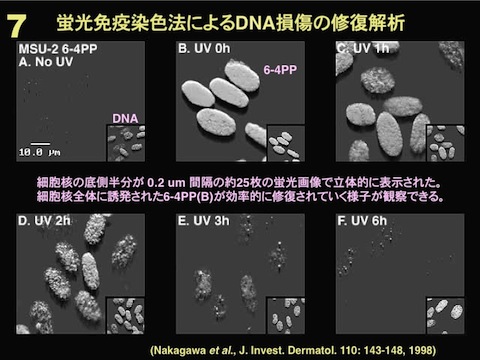
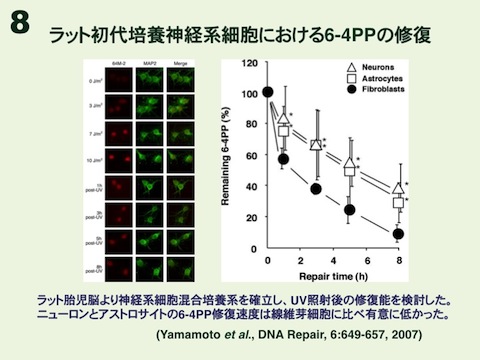
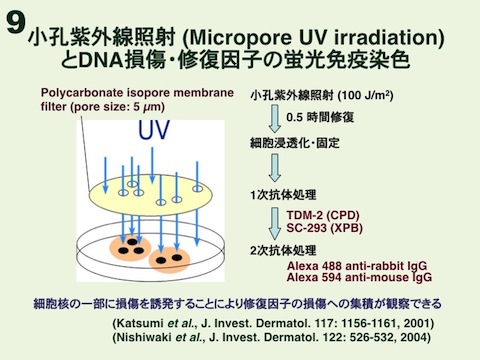
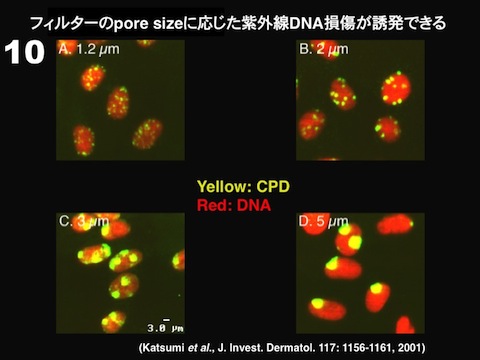
これらの紫外線損傷抗体は様々な実験系に応用できます。酵素標識免疫法(ELISA、図4)に応用すれば、10J/平方メートルの254nm紫外線を照射されたヒト線維芽細胞におけるCPDや6-4PPの修復能力を調べることができます(図5)。また、抗体は高分子DNA(1本鎖)中の損傷に結合するため、免疫染色にも応用できます(図6)。線維芽細胞や神経細胞に紫外線を照射してから免疫染色すれば、細胞核全体にDNA損傷が観察されます(図7、図8)。さらに、直径5μmの小孔をもつフィルターを通して紫外線照射する「小孔紫外線照射法」(図9、図10)で細胞核の局所を照射してから、DNA損傷と修復蛋白を免疫染色すれば、損傷部位への修復蛋白の集積を調べることもできます(図11)。
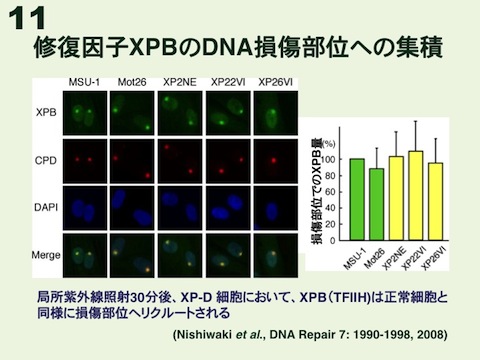
2-3)アセチルアミノフルオレン(AAF)-DNA付加体に対するモノクローナル抗体
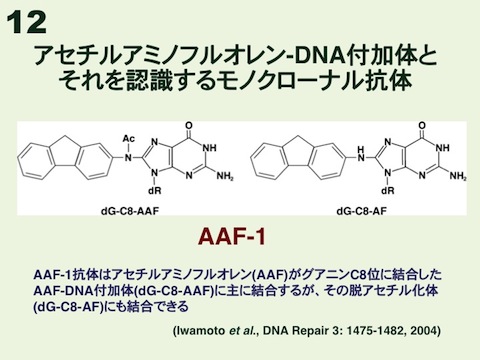
AAFは実験動物において、肝臓がんを中心に膀胱がんや乳がん等を誘発するため、70年以上前から使われてきたおなじみの発がん剤である。発がんの原因として注目されているのは、DNAグアニン残基への結合体であるAAF-DNA付加体の形成である。特に、グアニンC8位の付加体であるdG-C8-AAFおよびその脱アセチル化体dG-C8-AFが重要で、生成量も多い(図12)。
私達は、AAF-ssDNA-mBSAを抗原に用い、DNA中のdG-C8-AAFに特異結合するAAF-1抗体を樹立した。AAF-1の安定結合には損傷本体であるdG-C8-AAFに加え、その両側に連なるDNA領域が必要である。また、親和性は少し低下するがDNA中の脱アセチル化体dG-C8-AFにも結合する。私達の抗体は高分子DNA中のAAF付加体に結合できる世界初のものであり、細胞や組織切片中のDNA付加体を免疫染色できる。
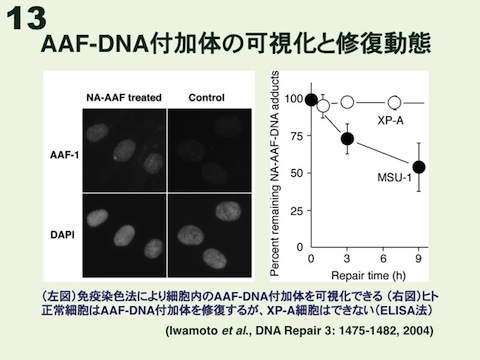
AAF-1は抗原特異性・親和性に優れ、ELISAに応用すれば、NA-AAF(活性型AAF)処理したヒト細胞におけるAAF-DNA付加体の修復能力を調べることができる(図13)。また、免疫染色に応用すれば、ヒト細胞の核全体にAAF-DNA付加体の形成を可視化できる。
2-4)エクインエストロゲン-DNA付加体に対するモノクローナル抗体
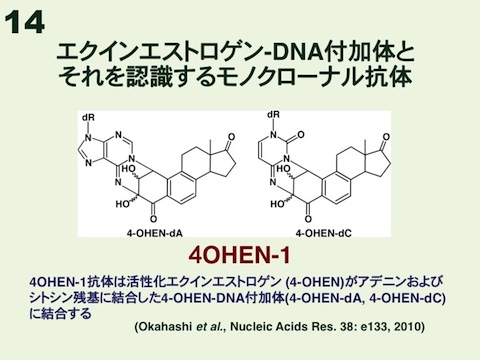
更年期障害女性に対するエストロゲン補充療法の代表薬プレマリンの長期服用で、乳がんなどの発がんリスクが上昇する。妊娠馬の尿から製造されるプレマリンに混在するエクインエストロゲン(エキレニンなど不飽和B環エストロゲン)は、生体内で水酸化反応や酸化還元反応を受け、最終的にDNAのシトシン、アデニンおよびグアニン残基に結合する4-OHEN-DNA付加体(4-OH型エキレニンDNA付加体)を形成する(図14)。さらに、これら3種類の4-OHEN-DNA付加体にはそれぞれ4種類の立体異性体があり、理論上12種類(4-OHEN-dC1-4,4-OHEN-dA1-4および4-OHEN-dG1-4)が存在する。その中で、主要なものは4-OHEN-dC3、-dC4、-dA3および-dA4と考えられている。
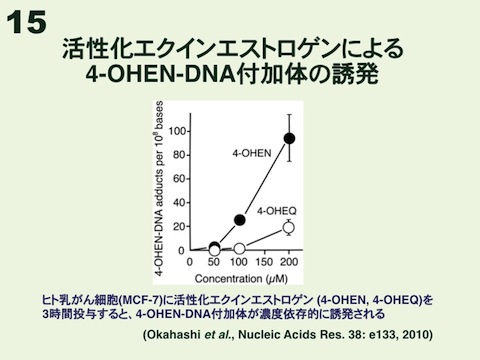
4-OHEN-ssDNA-mBSAを抗原に用いて筆者らが世界で初めて樹立した4OHEN-1抗体は、生成量の多いアデニンおよびシトシン残基に連結した4-OHEN-DNA付加体に結合する。立体異性体でいえば、主要なものとされる4-OHEN-dA3、-dA4、-dC3および-dC4に結合するが、特に4-OHEN-dA3および4-OHEN-dC3と強く結合する。この4OHEN-1抗体をELISAに応用して、乳がん細胞(MCF-7)における活性型エクインエストロゲン(4-OHEN,4-OH型エキレニン;4-OHEQ,4-OH型エキリン)による4-OHEN-DNA付加体の誘発を調べることができる(図15)。このDNA付加体については標準損傷DNAがあるので、ELISAの損傷量を絶対的な数値で表している。
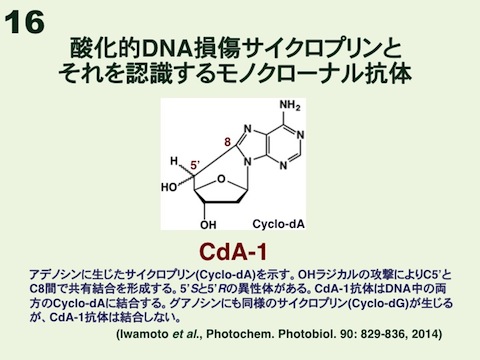
2-5)酸化的DNA損傷サイクロプリンに対するモノクローナル抗体
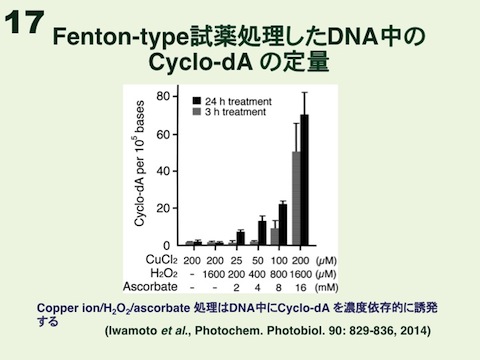
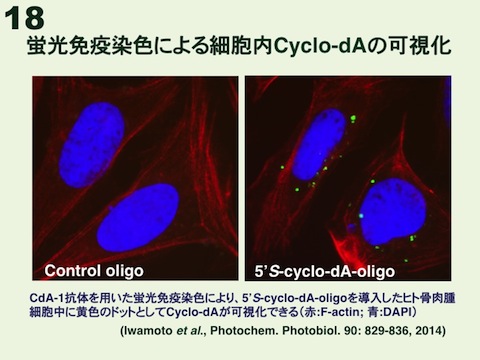
XPの中で最も重篤な症状を呈するのはXP-A群であり、その患者数は日本が世界で一番多い。それ故、日本人研究者はこの病気の原因究明に真摯に取り組まなければならない。XP-A群患者は太陽光を徹底的に遮断して生活することで皮膚がんを回避できる。しかし、全員が幼少期より進行性の神経障害を発症してしまうが、有効な治療法はなく大きな問題となっている。神経障害の発症メカニズムに関する代表的仮説は、脳は酸素を大量に消費することから活性酸素を介して、XP患者が修復できない特別な酸化的DNA損傷が生成・蓄積する結果、RNA合成が阻害され神経細胞が死に至るとするものである。有力候補損傷として、サイクロプリン(Cyclo-dAとCyclo-dG)が考えられている。これは、アデノシンやグアノシンにおいて、活性酸素のヒドロキシルラジカルが糖部C5’位の水素を引き抜くことにより生じる糖ラジカルを経由して、C8位とC5’位間で共有結合を形成したものであるが、酸化的DNA損傷でありながらNERで修復される。私達は8年の試行錯誤の末、Cyclo-dA含有オリゴヌクレオチド-蛋白結合体を抗原に用いて、Cyclo-dAに対する抗体の作製に世界で初めて成功した(図16)。このCdA-1抗体をELISAに応用して、Fenton-type試薬を裸のDNAに処理すると、濃度依存的にCyclo-dAが誘発されることがわかった(図17)。この付加体については標準損傷ヌクレオチドがあるので、ELISAでの損傷量を絶対的な数値で表している。また、蛍光免疫染色法を用いて、5’S-cyclo-dA-oligoを導入したヒト骨肉腫細胞中にドット状にCyclo-dAを可視化することができた(図18)。今後、XP-A患者剖検脳切片中のCyclo-dAの検出が期待される。
































 〒634-8521 奈良県橿原市四条町840番地
〒634-8521 奈良県橿原市四条町840番地